Todo el mundo está familiarizado con el concepto de átomo. De hecho las palabras átomo o molécula forman parte del vocabulario corriente. Sin embargo, de vez en cuando, aparece alguien que, ante la presentación de un resultado de la investigación científica, pregunta cómo se puede estar tan seguro de algo que no se ha visto o no se ha tocado. Algunos llegan incluso al extremo de hablar de fe, equiparando la “creencia” en los átomos con su derecho a creer en su dios preferido. A continuación damos tres respuestas a la pregunta “¿cómo podemos saber realmente que los átomos existen?”. Estas respuestas se caracterizan por el hecho de que cualquiera puede reproducir los experimentos en cualquier lugar y obtendrá siempre los mismos resultados. Las creencias religiosas o en pseudociencias no pueden dar respuestas así.
Desde al menos la época de los antiguos griegos muchos pensadores han postulado la existencia de los átomos. Por “átomos” los griegos se referían a unas esferas de materia tan pequeñas que eran invisibles, duras e irrompibles, que constituían los diferentes elementos de los que se formaban los objetos materiales en el mundo físico. Esta idea fue despreciada durante muchos siglos hasta que volvió a surgir durante la Revolución Científica del siglo XVII gracias a pensadores de la talla de Descartes, Boyle, Newton o Gassendi. La investigación del calor y de la química durante el siglo XIX aportó grandes apoyos a la existencia de estos supuestos átomos que, por supuesto, nadie podía ver (y que hoy día apenas podemos adivinar con la tecnología actual). El siglo XX vería la confirmación de su existencia más allá de toda duda razonable.
Así pues, ¿cómo sabemos que los átomos existen realmente? Daremos tres respuestas en orden cronológico.
La primera respuesta es la ley de las proporciones definidas o ley de Proust: las investigaciones químicas a finales del siglo XVIII y principios del XIX mostraron que los elementos participan en los compuestos en proporciones que siempre son expresables como números naturales asignados a cada elemento. Estos compuestos nunca presentaban la participación de un elemento como una parte de una unidad, sugiriendo que son unidades indivisibles de cada elemento, que podemos llamar átomos. Por ejemplo, 1 unidad de sodio se combinaba con una unidad de cloro para obtener 1 unidad de sal, pero nunca 1,5 unidades de sodio con 1,1 unidades de cloro. Esta ley, puramente experimental, recibió apoyo teórico cuando John Dalton publicó su teoría atómica en 1803.
La segunda respuesta es la teoría cinética de los gases o la distribución de Maxwell-Boltzmann: a lo largo del siglo XIX las investigaciones en termodinámica y en el estudio de los gases demostraron que la teoría atómica de la materia era capaz de dar cuenta de muchas propiedades de la materia que no pueden ser fácilmente explicadas de cualquier otra manera. A finales de siglo se pudo demostrar que las propiedades de los gases y el comportamiento del calor como una forma de energía en diferentes situaciones se podían explicar por los movimientos e interacciones de átomos que obedecen las leyes del movimiento de Newton. En 1859 James Clerk Maxwell da a conocer su distribución de las velocidades moleculares, la primera ley estadística de la historia, que proporcionaba el número de moléculas cuya velocidad está en un rango dado. En 1871 Ludwig Boltzmann la generaliza. Una ley fundamental de la naturaleza, la segunda de la termodinámica, se expresa como el logaritmo de una probabilidad.
Pero aún había algunos que sugerían que, si bien la hipótesis atómica era útil y conveniente, eso no la hacía necesariamente válida. La tercera respuesta a la pregunta es la decisiva y es la explicación del movimiento browniano: en 1905 Albert Einstein demostró que la teoría atómica es la única capaz de dar una explicación detallada del movimiento puramente aleatorio de unos granos de polen microscópicos suspendidos en un líquido estacionario. El fenómeno, conocido como movimiento browniano cuando se trata de polen (su nombre general es pedesis), podía ser explicado asumiendo solamente que los granos suspendidos estaban sujetos a colisiones aleatorias por las mucho más pequeñas moléculas del fluido, que impactaban en el grano desde diferentes direcciones. Comparaciones muy cuidadosas en los años siguientes entre las predicciones de Einstein y los movimientos aleatorios observados demostraron una completa coincidencia. Desde entonces nadie ha dudado seriamente de la existencia de los átomos.
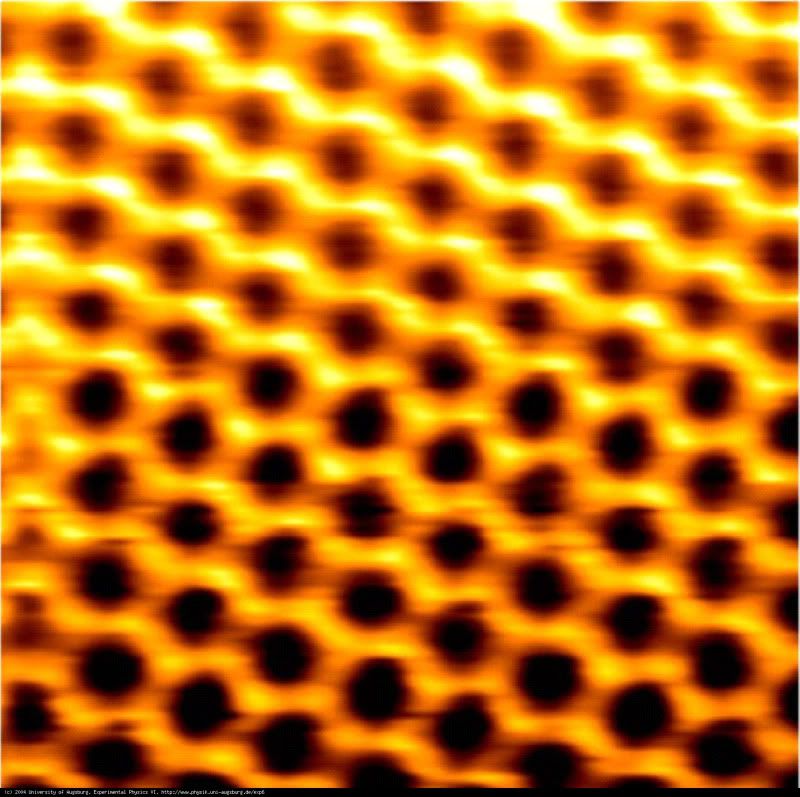
Imagen: Fotografía de la estructura atómica del grafito obtenida con un microscopio de fuerza atómica. Cada vértice de cada hexágono es un átomo de carbono. Cortesía de la Universidad de Augsburgo (Alemania).
[Esta es la participación de Experientia docet en el IX Carnaval de la Física que este mes de julio tenemos el honor de albergar.]
6 comentarios:
Fascinante artículo, César.
Un viaje desde una escéptica -y por ende, necesaria- pregunta sobre la existencia de los átomos hacia una resolución final e indiscutible, con paradas históricas en los hombros de gigantes de la ciencia...
Original planteamiento.
A mí siempre me ha asombrado la aportación de Boltzmann, tan valiente ...y creativa. Todo un pesonaje.
Otra figura importante de la teoría cinética de los gases sería Gibbs, y sus coincidencias y a veces controversias, con Boltzmann...
Gran entrada. Resumir tanta información en tan poco espacio es todo un arte.
Me ha encantado. Saludos
Muchas gracias, Dani. Muy amable.
¡Muy bueno! Pero ahora tenéis que complementarlo con una entrada que sea "¿Cómo sabemos de la existencia de las partículas subatómicas? ;-)
Excelente tu blog.
¡Qué vergüenza!A estas alturas y la pregunta me había dejado descolocado. Está bien recordar las respuestas a cuestiones tan "simples". La ley de Proust y el movimiento browniano son respuestas simples, elegantes y convincentes desde hace ya algún que otro siglo.
Un artículo excepcional, gracias.
Aparte de que me ha parecido muy didáctico sólo puedo decir que me uno a la petición de Vanesa. :)
Publicar un comentario