Cuando Boris P. Belousov, a la sazón director del Instituto de Biofísica de la Unión Soviética, envió un artículo en 1951 a un prestigioso journal científico en el que afirmaba que había encontrado una reacción química oscilante, se encontró con un rechazo rotundo. De hecho recibió una nota del editor, un prestigioso bioquímico, en la que, tajantemente, afirmaba que eso era, simple y llanamente, “imposible”. Y eso a pesar de que el procedimiento para llevar a cabo la reacción no podía ser más sencillo para un laboratorio como el de este editor, pero su convicción de que eso no podía ser era tan profunda que ni se tomó la molestia de comprobarlo experimentalmente.
En muchos campos de la ciencia existen fenómenos periódicos, sistemas que oscilan siguiendo pautas. Imaginemos, por ejemplo, un péndulo (física), los ritmos circadianos (biología) o las funciones sinusoidales (matemáticas). Pero, ¿es posible un sistema químico oscilante? Tras un poco de reflexión es probable que se llegue a la conclusión de que no es posible su existencia porque se estaría violando la Segunda Ley de la Termodinámica, así, con mayúsculas. Muchos grandes químicos, incluido el editor que rechazó el artículo de Belousov, han sido de esta opinión. El problema de este enfoque es que es erróneo de raíz. A todos los que hemos estudiado algo de física o matemáticas nos han hecho siempre mucho hincapié en la importancia de saber para qué condiciones de contorno está desarrollada una determinada fórmula y que, aplicarla fuera de esas condiciones, no tiene sentido matemático/físico. Al afirmar que una reacción química oscilante no es posible estamos incurriendo exactamente en este error: aplicamos los conceptos de la termodinámica del equilibrio (desarrollada por Gibbs a finales del siglo XIX y prácticamente la única que se estudia durante los estudios de grado/licenciatura) a todos los sistemas, pero olvidamos que existen sistemas que están lejos del equilibrio para los que no tiene sentido físico su uso.
Belousov había estado intentando crear un modelo del ciclo de Krebs cuando, completamente por accidente, observó que una disolución de ácido cítrico, bromato (BrO3-) y una sal de cerio (Ce) oscilaba periódicamente entre amarillo e incoloro. Sin embargo, debido a la resistencia entre la comunidad química a aceptar la mera posibilidad teórica de los osciladores químicos, el trabajo no se pudo publicar [1] hasta años después y sólo en los resúmenes de una oscura conferencia médica. Aquel “incidente” acabó con la carrera de Belousov.
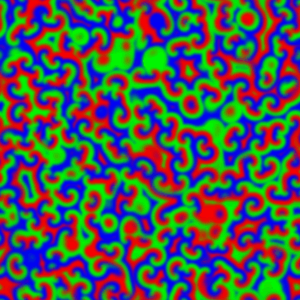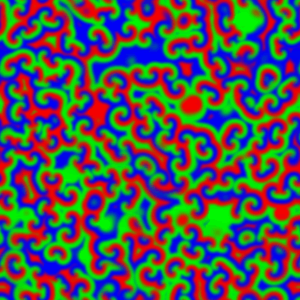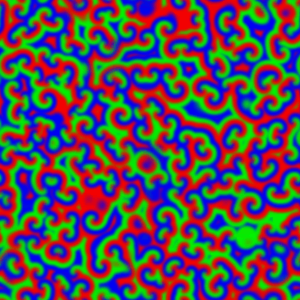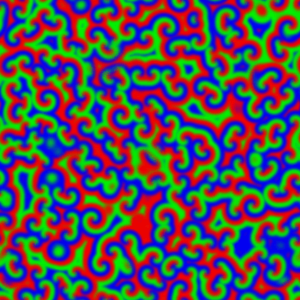
Afortunadamente el testigo fue recogido años después por otro biofísico, Anatol M. Zhabotinsky, actualmente en la Universidad Brandeis (EE.UU.). Zhabotinsky refinó la reacción, reemplazando el ácido cítrico por malónico y descubriendo que cuando una fina capa homogénea de los reactivos se deja evolucionar sin intervención posterior, aparecen fascinantes patrones geométricos [imagen izquierda] como círculos concéntricos y espirales de Arquímedes que se propagan por el medio (véase vídeo 1, vídeo 2). Por lo tanto, la reacción oscila tanto en el tiempo como en el espacio, por lo que es un oscilador espaciotemporal. Zhabotinsky también se encontró con la resistencia de los editores que usaban el argumento de la imposibilidad termodinámica, pero un conocimiento más extendido de la termodinámica del no-equilibrio permitió que Zhabotinsky consiguiese publicar [2] finalmente varios artículos sobre la que hoy se conoce como reacción de Belousov-Zhabotinsky o, simplemente, reacción BZ. Las pruebas estaban ahí: las reacciones químicas podían oscilar, y hacerlo periódicamente.
Pero la reacción BZ se quedaría en una mera curiosidad si no se pudiese describir completamente lo que ocurre en realidad. Y una descripción no es completa si su dinámica no puede expresarse en el lenguaje de la ciencia: las matemáticas. A principios de los años 70 del siglo pasado Richard Noyes, Richard Field y Endre Koros, los tres en la Universidad de Oregón (EE.UU.), propusieron [3] un mecanismo consistente en 18 reacciones químicas y 21 especies químicas diferentes o, lo que es lo mismo, un espectacular e intimidante sistema de ecuaciones diferenciales para describir las velocidades de las distintas reacciones. El sistema es tan difícil de aprehender que los autores crearon una simplificación del mecanismo, llamada “Oregonator”, para poder explicarlo. A pesar de su relativa simplicidad, el Oregonator es capaz de capturar el comportamiento “cualitativo” de la reacción BZ.
El Oregonator reduce las reacciones de 18 a 5. Aparecen a continuación junto a las velocidades de reacción asociadas (v):
BrO3- + Br-- -> HBrO2 + HOBr // v1 = k1[BrO3-][Br-]
HBrO2 + Br-- -> 2HOBr // v2 = k2[HBrO2][Br-]
BrO3- + HBrO2 -> 2HBrO2 + 2Ce4+ // v3 = k3[BrO3-][HBrO2]
2HBrO2 -> BrO3- + HOBr // v4 = k4[HBrO2]2
B + Ce4+ -> 1/2fBr- // v5 = kc[B][Ce4+]
Donde B representa todas las especies orgánicas oxidables presentes y f es un factor estequiométrico que recoge la química orgánica presente. Recordemos que en la notación de las velocidades de reacción las especies entre corchetes representan la concentración (en una unidad apropiada, habitualmente moles por litro) de dicha especie. Las ki son simplemente constantes de reacción que dependen de la temperatura y deben determinarse experimentalmente.
Con objeto de facilitar la lectura vamos a llamar A a la concentración de BrO3-, B a la de todas las especies orgánicas oxidables, P a la del HOBr, X a la del HBrO2, Y a la del Br- y Z a la del Ce4+. Si todavía hacemos una simplificación más y tratamos a las concentraciones A y B como constantes, entonces las velocidades de reacción de X ,Y ,Z, que describen el comportamiento de este sistema simplificado serían (P, es un producto y por tanto depende de X ,Y , Z, A y B):
dX/dt = k1AY - k2XY + k3AX – 2k4X2
dY/dt = - k1AY – k2XY + f/2·kcBZ
dZ/dt = 2k3AX – kcBZ
Este sistema de ecuaciones diferenciales se resiste a ser resuelto analíticamente pero se puede abordar por métodos numéricos. Cuando A = 0,06M, B=0,02M y f =1, se puede observar efectivamente un comportamiento oscilatorio:
La descripción del mecanismo y de la dinámica de la reacción BZ ha posibilitado su uso como modelo para el estudio de otros sistemas complejos como el crecimiento bacteriano [imagen derecha, D. discoideum] o el estudio de ciertas propiedades de las neuronas. También basándose en la reacción BZ se pueden crear puertas lógicas “húmedas”.
Referencias:
[1]
Belousov B. P., A periodic reaction and its mechanism,in Collection of short papers on radiation medicine for 1958, Med. Publ., Moscow, 1959.
[2]
Zhabotinsky, A. M., Periodical oxidation of malonic acid in solution (a study of the Belousov reaction kinetics), Biofizika, 9, 306-11 (1964).
[3]
Field, R. J., Koros E., and Noyes, R. M., Oscillations in chemical systems .2. Thorough analysis of temporal oscillation in bromate-cerium-malonic acid system, J. Amer. Chem. Soc. 94, 8649-64 (1972).
Esta entrada es la segunda participación de Experientia docet en el XV Carnaval de la Física que este mes organiza Curiosidades de la Microbiología.
Esta entrada es la tercera participación de Experientia docet en el I Carnaval de la Química que organiza Ese punto azul pálido.
Esta entrada es la segunda participación de Experientia docet en el X Carnaval de Matemáticas que organiza La Ciencia de la Mula Francis.


Triplete.
ResponderEliminarGran entrada.
Esta es lejos mi reacción favorita. Como infidencia contar que la descubri hace unos 3 meses gracias a las redes sociales (tumblr especificamente)
ResponderEliminarCreo que la química oscilante como un primer paso para el estudio de cinéticas fuera del equilibrio ya fue dado, ahora queda todo un campo nuevo y desconocido derivado de estudios como este y los de Ilya prigogine. Muchas son las cosas donde aún los cientificos no nos hemos aventurado a indagar y por cierto, para mi, este es un desafío particular en unos años más.
Me Alegro que la hayan colocado en Experentia Docet. Gran Articulo.
Martín - Chile.
http://laciudadatomica.blogspot.com/
Creo que estamos sumergidos en una geometría espacial y todo sigue una cadencia, un ritmo, un compás en torno a ella.
ResponderEliminarLas mismas reacciones y enlaces químicos dependen de la estructura espacial de los átomos.
El orden, las órbitas, las leyes son una constante del Universo a pesar de la entropía.
AnaMSanPer
Ana María Sánchez.