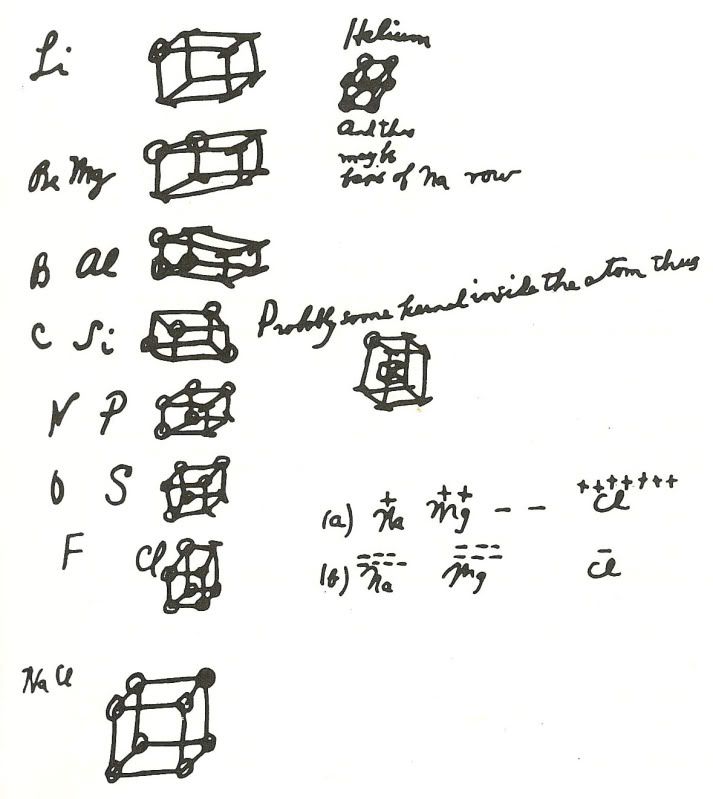
Una vez que los físicos que estudiaban la estructura del átomo comenzaron a darse cuenta de que los electrones que rodeaban el núcleo tenían una disposición especial, los químicos comenzaron a investigar cómo estas teorías se correspondían con la química conocida de los elementos y su capacidad para formar enlaces. Gilbert Newton Lewis (1875-1946) fue clave en el desarrollo de una teoría del enlace basada en el número de electrones de la capa más externa de electrones del átomo, la capa de “valencia”. En 1902, mientras estaba tratando de explicar el concepto de valencia a sus estudiantes, representó los átomos como constituidos por una serie de cubos concéntricos con electrones en cada vértice.
Este “átomo cúbico” explicaba los ocho grupos de la tabla periódica y representaba su idea de que los enlaces químicos se formaban por una transferencia electrónica para completar el conjunto de ocho electrones más externos (un “octeto”). La teoría de Lewis del enlace químico continuó evolucionando y, en 1916, publicó su artículo fundamental [*] en el que sugería que el enlace químico era un par de electrones compartidos por dos átomos. (El investigador de la General Electric Irving Langmuir elaboraría esta idea e introduciría el término enlace covalente). Para los casos en los que no se compartían los electrones, Lewis redefinió en 1923 el concepto de ácido como cualquier átomo o molécula con un octeto incompleto que era, por tanto, capaz de aceptar electrones de otro átomo; las bases eran, por consiguiente, donantes de electrones.
La contribución de Lewis también fue importante en el desarrollo de la termodinámica y en la aplicación de sus leyes a sistemas químicos reales. A finales del siglo XIX, cuando comenzó a trabajar, la ley de conservación de la energía y otras relaciones termodinámicas existían como ecuaciones aisladas. Lewis se basó en el trabajo de otro pionero de la termodinámica, Josiah Willard Gibbs (Universidad de Yale), cuyas contribuciones se estaban conociendo muy lentamente. El trabajo de ambos fue fundamental para poder predecir si una reacción avanzaría hasta casi consumir todos los reactivos, si alcanzaría un equilibrio o si no tendría lugar en absoluto, y también para determinar si una mezcla de sustancias podría ser separada por destilación.
Lewis fue educado en su casa hasta que cumplió los 14 años. Su educación posterior fue más convencional, culminando con un doctorado por la Universidad de Harvard que le dirigió Theodore Richards. Posteriormente haría la peregrinación a Alemania de los químicos y físicos que querían estar a la vanguardia de la investigación a finales del XIX y primeras décadas del XX, trabajando con Walter Nernst (U. Gotinga) y Wilhelm Ostwald (U. Leipzig). Ocupó varias posiciones académicas, las más notables en el Instituto de Tecnología de Massachusetts (EE.UU.) y en la Universidad de California en Berkeley (EE.UU.), donde amplió los programas de química e ingeniería química.
Esta entrada es la participación de Experientia Docet en la II Edición del Carnaval de Química que organiza El busto de Palas.
Referencia:


3 comentarios:
Genial artículo, César.
Un pregunta: ¿la imagen es un manuscrito de Lewis? Intuyo que sí, pero es por confirmarlo.
La verdad es que me encantan los manuscritos de los grandes personajes de la ciencia, algunos son auténticas obras maestras.
Saludos
Gracias, Dani.
Si no me equivoco es el documento original de 1902.
Pues es una joya.
Gracias por tu rápida respuesta.
Publicar un comentario