Se sabe desde hace décadas que la abundancia en la Tierra del xenón es menor de lo que debería ser según las proporciones observadas del resto de gases nobles. Las abundancias de estos gases se usan por los geoquímicos para evaluar y datar los principales procesos terrestres, incluyendo la formación de la atmósfera. Para poder hacerlo parten de una hipótesis básica: que los gases nobles son inertes en toda circunstancia. Un trabajo realizado por Gary Schrobilgen y David Brock, de la Universidad McMaster (Canadá), cuyos resultados se publican en el Journal of the American Chemical Society explica la baja abundancia del xenón y pone en evidencia que el xenón no es tan noble como se suponía.
Los primeros indicios de la anomalía aparecieron en los años 70 del siglo pasado, cuando se comprobó que el xenón es unas 20 veces menos abundante en la atmósfera que los otros gases nobles. Y eso a pesar de que el estudio de los meteoritos sugiere que su abundancia en el Sistema Solar debería ser aproximadamente la misma. Aparecieron varias hipótesis: que el xenón se había escapado al espacio, o había quedado atrapado en las capas polares o en las rocas sedimentarias. Pero los cálculos indicaban que estos procesos sólo podían justificar, en el mejor de los casos, una quinta parte del gas que faltaba.
En el 2005, sin embargo, se descubrió que a altas presiones y temperaturas el xenón parece que es capaz de desplazar al silicio en el cuarzo (dióxido de silicio cristalino). Los investigadores proponían que al cambiar sitios con el silicio el xenón se uniría a dos oxígenos a ambos lados. Si esto fuese así podría justificar la pérdida de xenón en un pasado distante, quizás durante una época de continuos bombardeos con meteoritos ricos en cuarzo. El problema era que se suponía que el xenón no reacciona con el oxígeno.
Schrobilgen y Brock han venido a reforzar esta hipótesis al demostrar que el xenón puede unirse al oxígeno. Añadieron cristales de tetrafluoruro de xenón (XeF4) a agua en el punto de congelación en presencia de ácido sulfúrico para producir un sólido amarillo-naranja por hidrólisis. Un análisis espectroscópico demuestra que este sólido es óxido de xenón (XeO2). Además, la espectroscopia Raman confirma que la estructura local (debemos tener en cuenta que esto es una red extensa) corresponde a un Xe(IV) unido a cuatro átomos de oxígeno (en la imagen) con una geometría cuadrada y plana. Finalmente los espectros vibracionales del XeO2 casan con la idea del cuarzo dopado con Xe.Esta entrada participa en la III Edición del Carnaval de Química que organiza Experientia docet y en la I Edición del Carnaval de Geología que organiza Un geólogo en apuros.
Referencia:
Brock, D., & Schrobilgen, G. (2011). Synthesis of the Missing Oxide of Xenon, XeO2, and Its Implications for Earth’s Missing Xenon Journal of the American Chemical Society DOI: 10.1021/ja110618g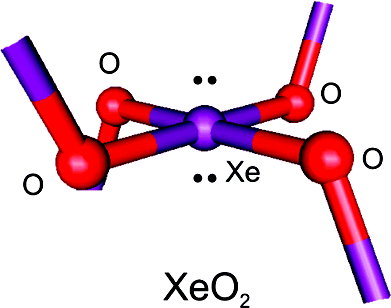

¡Gracias por participar en el Carnaval de Geología!
ResponderEliminarMe ha parecido realmente interesante la cuestión de que el Xenón no es ni tan noble ni tan inerte como nos lo pintaban en las clases de química. Nunca hubiese podido imaginarme que se uniría al oxígeno, y aún menos que pudiera desplazar al silicio en la estructura cristalina.
¡Un saludo!
Luego la expresión "ligo menos que un gas noble" no es tan correcta.
ResponderEliminarBuen inicio de carnaval, César. Muy didáctico.
Muy interesante, César. Óxido de Xenón...curioso compuesto.
ResponderEliminarSaludos.