 |
| La emisión del carbón diatómico contribuye al color azul de esta llama. |
El carbono elemental, es decir, sin combinar con ningún otro
elemento químico, puede presentarse con estructuras diferentes. Cada
una de estas estructuras se denomina un alótropo y en cada una de
ellas los enlaces químicos y la disposición cristalina es
diferente. Los más conocidos son probablemente el diamante, el
grafito (la mina de los lápices), el grafeno, los fulerenos y los
nanotubos, aunque hay muchos más. Uno de esos alótropos es el C2,
el carbón diatómico, aislado en los arcos eléctricos y en llamas
azules (combustión completa) de hidrocarburos, y detectado en el
espacio interestelar, en las atmósferas de algunas estrellas y en
los cometas. No debe confundirse con otro alótropo, el (-C=C-)n
Si has leído lo anterior y no te ha llamado nada la atención es
que tenemos que repasar un poquito de química básica. El carbono
tiene la propiedad característica de unirse consigo mismo de
diversas maneras, como demuestran los alótropos, y a otros elementos
formando una variedad de enlaces químicos, lo que explica la
extensión y complejidad de la química orgánica en su conjunto y de
la vida en la Tierra en particular. El átomo de carbono puede formar
cuatro enlaces, que pueden ser con cuatro especies diferentes, o con
alguna llegan a ser dobles (como con el oxígeno) o incluso triples
(consigo mismo). El carbono tenderá a formar siempre sus cuatro
enlaces y, si no lo hace, estamos ante un radical, un átomo con un
electrón libre que no participa en el enlace que le toca y que hace
al átomo, y a la molécula en que participe, extremadamente
reactivo.
Si leemos de nuevo el párrafo de apertura, ¿qué nos llama la
atención? Efectivamente, si existe un alótropo del carbono que es
C2, si suponemos que entre los carbonos hay un triple
enlace llegamos a la conclusión de que debería ser un ¡diradical!
Pero eso sería la reactividad absoluta y formaría tan rápidamente
agrupaciones que tendría una vida media probablemente de
picosegundos y, sin embargo, existe. ¿Cómo es posible? Muy fácil:
los átomos de carbono forman un cuádruple enlace entre sí. Esta es
la propuesta que hizo Paul von Ragué Schleyer hace 20 años y que
ahora un equipo encabezado por Sason Shaik, de la Universidad Hebrea
de Jerusalem (Israel), ha venido a confirmar. Los resultados se
publican en Nature Chemistry.
El equipo de Shaik analizó la energía del cuarto enlace y
comparó sus resultados teóricos con los datos experimentales
disponibles. Su fuerza es de sólo un 15% de la fuerza de los
primeros tres enlaces, pero es mayor que la de un enlace de
hidrógeno, con lo que es suficiente para disminuir su reactividad.
Es difícil tener una imagen intuitiva, geométrica, de este
cuarto enlace. Digamos que está “colgando” entre los orbitales
híbridos que apuntan en sentidos opuestos en el eje de la molécula.
El equipo de investigadores llegó a sus conclusiones después de
realizar cálculos mecanocuánticos de la diferencias de energía
entre los estados singlete y triplete del cuarto enlace y comprobando
que sus resultados cuadraban con los datos experimentales. Recordemos
que en el estado fundamental singlete los dos electrones que
participan en un enlace tienen espín opuesto, mientras que en el
excitado triplete los electrones tienen el mismo espín. Esto quiere
decir que si no existiese diferencia en la energía, o fuese muy
pequeña (2 ó 3 kcal/mol a lo sumo), entre estos dos estados la
molécula sería un diradical. Pero resulta que el triplete está a
unos respetables 26 kcal/mol por encima del singlete, por lo que en
estado fundamental existe un enlace.
La regla de cálculo estimativa afirma que la fuerza intrínseca
de un enlace es la mitad de la diferencia entre el estado triplete y
el singlete, lo que nos dice que este enlace tiene una fuerza de unos
13 kcal/mol. Los investigadores se toman el trabajo de calcularla de
cuatro formas distintas para llegar a un rango de 11,6-14,8 kcal/mol
El inteligente lector se preguntará en este punto, ¿existen
cuádruples enlaces también en los análogos del carbono, como el
silicio y el germanio? Y la respuesta es no, en Si2 y Ge2
sólo hay dobles enlaces. Pero en análogos electrónicos del C2
como CN+, BN y CB-, sí hay cuádruples
enlaces. ¡Lo que nos quedará por ver!
Esta entrada es una participación de Experientia docet en la XII Edición del Carnaval de la Química que organiza Historias con mucha química (como todas).
Esta entrada es una participación de Experientia docet en la XII Edición del Carnaval de la Química que organiza Historias con mucha química (como todas).
Referencia:
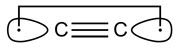
1 comentario:
¡Me encanta, César! carbono, diversidad, vida, cuántica... Muchas gracias por esta preciosa contribución al carnaval.
Publicar un comentario