Si miramos una tabla periódica veremos que el
silicio (Si) se sitúa justo debajo del carbono (C). Ello quiere
decir que las capas electrónicas externas tienen el mismo número de
electrones en los mismos tipos de orbitales, por lo que ambos
elementos tendrán químicas parecidas. Tanto es así que, en alguna
ocasión, se ha especulado incluso con la posibilidad de existencia
de vida basada en silicio. Es una especulación, porque la cercanía
energética relativa de los orbitales d en el silicio hace que
éstos entren en juego a la primera de cambio, modificando las
valencias del silicio. Este hecho se ha puesto de manifiesto de la
manera más espectacular en una serie de experimentos llevados a cabo
en el Laboratorio Nacional Oak Ridge (EE.UU.) por un equipo
encabezado por Wu Zhou, de la Universidad Vanderbilt, usando grafeno.
Los resultados se publican en Physical Review Letters.
El silicio es una de las impurezas que con mayor
facilidad se adsorben (con “d”, se ancla a la superficie, para
entendernos) sobre el grafeno que se crea por deposición de vapor y
afecta de forma notable a las características conductoras del mismo.
Por tanto, si se pretende algún día integrar el grafeno con la
microelectrónica basada en chips de silicio, es importante conocer
cómo se comportan estas impurezas. El equipo de investigadores ha
deducido la naturaleza de los enlaces de carbono y silicio en el
grafeno, hasta ahora desconocida, a las bravas: usando una
combinación de técnicas de microscopía electrónica para ver la
conformación estructural y, a partir de ahí, calcular los tipos de
enlaces implicados.
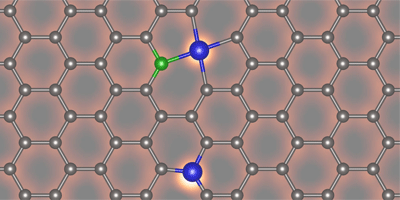
Simplificando, los investigadores lo que hicieron
fue, por una parte, lanzar electrones a la superficie del grafeno con
impurezas de silicio con un microscopio electrónico de transmisión
y medir la pérdida de energía de estos electrones y, por otra,
generaron imágenes de campo oscuro anular, un método que excluye el
haz de electrones no dispersados por el grafeno. La combinación de
ambas observaciones permite obtener las imágenes que ilustran este
texto, en las que se distinguen los átomos claramente y las
intensidades dan información sobre los enlaces químicos.
 |
| Átomo de Si (blanco) unido a tres átomos de C (azul) |
 |
| Átomo de Si (blanco) unido a cuatro átomos de C (naranja) |
Comparando estos datos espectroscópicos con cálculos
usando la teoría del funcional de la densidad se puede establecer
con facilidad (relativa) la diferencia entre un átomo de silicio
unido a cuatro o a tres átomos de carbono en el grafeno. En éste
los átomos de carbono tienen una hibridación de orbitales sp2
y se unen a otros tres átomos en un plano. En los casos en los que
el silicio se une a cuatro átomos ocupa el hueco correspondiente a
dos carbonos, con los orbitales d contribuyendo
significativamente al enlace, lo que resulta en una hibridación
exótica sp2d, también plana. Sin
embargo, cuando el silicio se une a tres átomos de carbono la
hibridación es sp3, esto es, tetragonal, y
el silicio queda fuera del plano del grafeno. Estas conclusiones
fueron recomprobadas a partir de cálculos de primeros principios.
Por si lo anterior no fuese demasiado claro: estos
métodos permiten estudiar las impurezas y sus enlaces a nivel de
átomos individuales. Si Linus Pauling levantara la cabeza...
Esta entrada es una
participación de Experientia
docet en la XIX Edición del Carnaval deQuímica que organiza Leet mi explain
Referencia:
1 comentario:
Excelente post (como el resto del blog).
Este tema es mas que interesante para los que estamos en el ramo de la electrónica.
Dicen que ya hay dispositivos electrónicos a base de Grafeno, incluso me han mostrado videos. Pero yo creo que por ahora es solo ficción, aunque dentro de poco deje de serlo.
Saludos.
Gustavo desde Argentina.
Publicar un comentario